암 생체에너지대사 표적, 약물내성 극복 항암전구약물 개발
생명과학부 지성길/ 이과대학 화학과 김종승 교수팀 논문 "Chem(Cell press)" 실려

▲ 왼쪽부터 Amit Sharma 박사, 이민구 박사, 원미애 박사, 지성길 교수, 김종승 교수
화학항암제 및 표적항암제를 비롯한 기존의 항암 치료 방식의 한계를 극복할 수 있는 약물내성 극복 치료기술이 국내 연구진에 의해 개발돼 화제다.
고려대 생명과학대학 생명과학과 지성길 교수, 이과대학 화학과 김종승교수, Amit Shama 박사, 이민구 박사, 원미애 박사, 성균관대 이진용 교수 및 (미)텍사스대 조나단 세슬러 교수 공동 연구팀은 “암 생체에너지대사를 표적으로 한 전구약물을 합성하여 기존 항암치료의 약물내성 한계를 극복할 수 있는 새로운 항암표적치료기술을 개발하였다.”고 밝혔으며 이에 따라 새로운 방식의 항암치료기술 개발에 대한 기대가 높아지고 있다.
약물 내성(Drug resistance)은 암이 선천적으로 가지고 있는 약물 회피 능력으로 인해 약물의 효율이 저하되는 현상을 일컬으며, 대표적인 약물 내성기전으로 1)세포막 수송체계 변화에 의한 약물의 세포 내 농도 최소화, 2)표적의 변형(유전자변이), 3)생화학적 변형에 의한 약물의 불활성화 및 4)약물의 효능을 회피하기 위한 대사 과정이 알려져 있다. 현재까지도 암세포의 약물내성으로 인한 재발 및 전이가 치료한계의 주요한 쟁점이며, 이러한 항암약물내성을 극복하기 위한 다양한 연구 및 치료법개발이 진행되고 있으나, 임상적으로 치료 효과가 미미한 실정이다.
1924년 노벨상 수상자인 독일의 생화학자 ‘Otto Warburg’에 의해서 정상세포는 미토콘드리아에서 주 에너지를 산화적 인산화(oxidative phosphorylation)에 의존하여 생성하지만, 정상세포와 달리 무한 증식을 보이는 암세포는 세포질에서 호기성 해당과정(aerobic glycolysis)으로 인한 젖산 생성을 주 에너지 대사과정으로 이용한다는 사실을 통해 암 특이적인 에너지대사가 존재함을 밝혔으며 이를 “Warburg effect (와버그 효과)”라 명명하였다. 이는 세포질에서 낮은 ATP 생성효율에도 불구하고 암세포는 산소의 존재 유무에 상관없이 정상 세포보다 많은 포도당을 빠르게 흡수하여 피루브산(pyruvate)을 젖산으로 전환시키는 해당과정을 통해 미토콘드리아 대사를 교란시켜 세포사멸을 차단함으로서 암 세포 증식을 유도한다.
발암초기단계에는 암세포의 빠른 성장과 관련한 에너지 및 대사를 충족시켜야하는 본질적인 필요성에 의해, 미토콘드리아에서 산화적 인산화(oxidative phophorylation)보다 세포질에서의 해당과정(glycolysis)이 일반적으로 우세하다. 이러한 에너지 대사의 두 과정에서 피루브산(pyruvate)은 매개체 역할을 하며, 이것은 미토콘드리아 내 효소인 피루브산 탈수소효소 (pyruvate dehydrogenase:PDH)에 의해 조절되어지고 PDH의 실제적인 활동은 피루브산 탈수소 인산화효소(pyruvate dehydrogenase kinase:PDK)에 의해 조절되어진다고 알려져 있다.
이번 연구의 화합물은 약물내성 조절물질로서 PDK(탈수소 인산화효소) 억제제로 알려진 디클로로 아세트산 (Dichloroacetic acid: DCA), 미토콘드리아 표적의 TPP 양이온 복합체 및 기존에 항암제로 알려진 독소루비신(doxorubicin)으로 구성되어있으며, 이 물질은 미토콘드리아를 표적으로 하여 탈수소 인산화효소를 저해함으로서 암세포의 비정상적인 호기성 해당과정을 정상적인 세포의 대사과정인 산화적 인산화 과정으로 유도시켜 선택적이면서도 단계적으로 항암약물을 방출시켜 세포사멸을 일으키는 특성을 이용한 새로운 암세포 항암치료표적기술을 개발하였다.
이렇게 개발된 약물내성항암치료제를 인간유래의 유방암 세포 및 독소루비신 내성을 가진 유방암 세포를 이용하여 마우스 종양이식모델에 투여한 결과, 디클로로 아세트산과 독소루비신이 없는 대조군에 비해 4배 이상 종양의 부피가 줄어든 것을 확인할 수 있었으며, 특이적인 약물부작용이 없음을 알 수 있었다.
이에 본 공동 연구팀은 암세포 특이적인 생체에너지 대사과정을 이해하고, 약물내성세포에서도 약물 내성을 우회하는 저분자 표적 항암전구약물을 합성하여 선택적으로 약물의 효능을 증가시켜 새로운 항암표적치료제를 개발하는데 성공하였다.
지성길,김종승 교수는 “현재 임상에서는 외과적 수술법, 방사선 및 항암화학요법이 최우선으로 행해지고 있지만, 암을 효과적으로 치료하기 위한 대안으로서 세포에너지 대사과정을 제어하면 항암화학요법의 한계 및 부작용으로 발생되는 재발 및 전이암까지도 극복할 수 있는 치료 뿐 만이 아니라 암환자에게도 건강회복 및 삶의 질 향상에 도움이 될 것으로 예상한다. 본 연구를 통해 개발된 암 생체대사에너지 표적 약물내성치료제는 기존 치료의 한계 및 부작용 문제를 해결하고 앞으로의 항암 치료 분야의 새로운 패러다임을 제시함으로서 커다란 반향을 이끌어 낼 것으로 기대된다.”고 밝혔다.
이번 연구의 결과는 화학분야 국제학술지 “Chem” (Cell press) 8월 23일자 온라인판에 게재 되었으며, 10월 11일 프린트판 논문으로 게재 될 예정이다. (논문명: Overcoming Drug Resistance by Targeting Cancer Bioenergetics with an Activatable Prodrug, 암 생체대사에너지를 표적으로 한 약물내성 극복약물 개발)
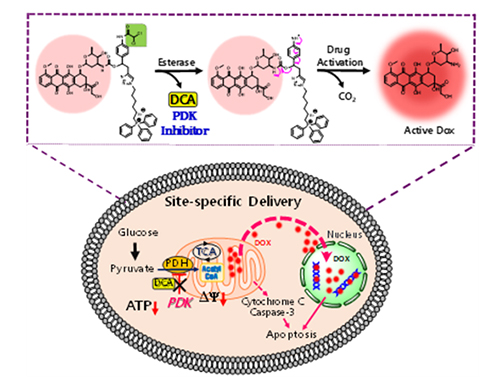
약물내성 암세포에서 표적항암전구약물은 esterase효소에 의해 활성화되어 미토콘드리아로 표적된 후, 방출된 DCA(PDK 억제제)는 호기성 해당과정이 아닌 미토콘드리아 산화적인산화과정으로 유도하여 항암제(DOX)가 서서히 방출되고, 시간에 따라 미토콘드리아에서 핵 쪽으로 이동한 DOX는 결국 세포사멸을 일으킴.
(DCA = dichloroacetic acid, PDK = pyruvate dehydrogenase kinase, PDH = pyruvate dehydrogenase complex, TCA = tricarboxylic acid cycle, DOX = doxorubicin, ATP = adenosine triphosphate, ψ = mitochondrial membrane potential)
출처: 고대뉴스