아미노펩티데이스 P 효소 작용에 의한 프롤린 아미노-말단 경로 확장
고려대학교 송현규 교수(생명과학부)와 캘리포니아 공과대학교(Caltech: California Institute of Technology) Alexander Varshavsky 교수 공동연구팀은 단백질 아미노-말단의 두 번째 위치에 프롤린(proline)을 갖는 단백질들이 Pro/N-degron 경로에 의해 제거되기 위해서는 아미노펩티데이스(aminopeptidase) P 효소 활성이 필수적임을 규명하였다. 고려대학교 대학원 생명과학과에서 박사학위를 취득하고 현재 연구교수로 재직 중인 김이현 박사(사진 1)가 주로 연구를 진행하였다. 본 연구 결과는 미국학술원회보(Proceedings of the National Academy of Sciences of the United States of America: PNAS)에 10월 19일자 온라인 발간되었다.
세포 내 포도당의 농도는 항상성을 유지해야 하는데 포도당 농도가 낮아지면 당신생(gluconeogenesis)이란 방법에 의해서 포도당이 생합성되는데 이때 여러 효소들이 관여한다. 포도당이 다시 많아져 당신생 과정을 억제해야 하면 GID복합체라고 불리는 E3 유비퀴틴-리가제가 관여해서 당신생에 관여하는 중요 효소들을 유비퀴틴-프로테오좀 경로에 의해서 분해한다.
이전 연구를 통해 GID 복합체의 한 단위체인 Gid4가 아미노-말단에 프롤린을 갖는 당신생 효소들을 인식하여 Pro/N-degron 경로에 의해 분해한다는 것이 밝혀져 있었다(그림 1A). 당시 첫 번째 프롤린 뿐만 아니라 두 번째 위치에 프롤린을 갖는 단백질 또한 분해가 되었는데 이 과정이 어떻게 가능한지 오랜 동안 밝히지 못하고 있었다.
본 연구를 통하여 지금까지 알려지지 않았던 아미노펩티데이스P가 작동을 해서 프롤린 앞에 위치한 첫 아미노산을 제거하고 아미노-말단을 프롤린으로 만든 다는 것을 밝혔다. 구체적으로 Nt-[Ala-Pro]-Aro10의 GID 복합체 의존적 분해에는 지금까지 기능이 밝혀지지 않았던 Fra1 효소 활성이 필수적이며, 또한 Nt-[Ser-Pro]-Pck1 분해의 경우 Icp55 아미노펩티데이스를 필요로 한다는 것을 밝혔다(그림 1B). Fra1, Icp55 및 GID 복합체는 진화 과정에서 보존되어 있기 때문에 Pro/N-degron 경로에 의해 분해되는 다양한 기질에 대한 연구로 확장될 수 있는 중요한 발견이다.

[사진1] 김이현 박사
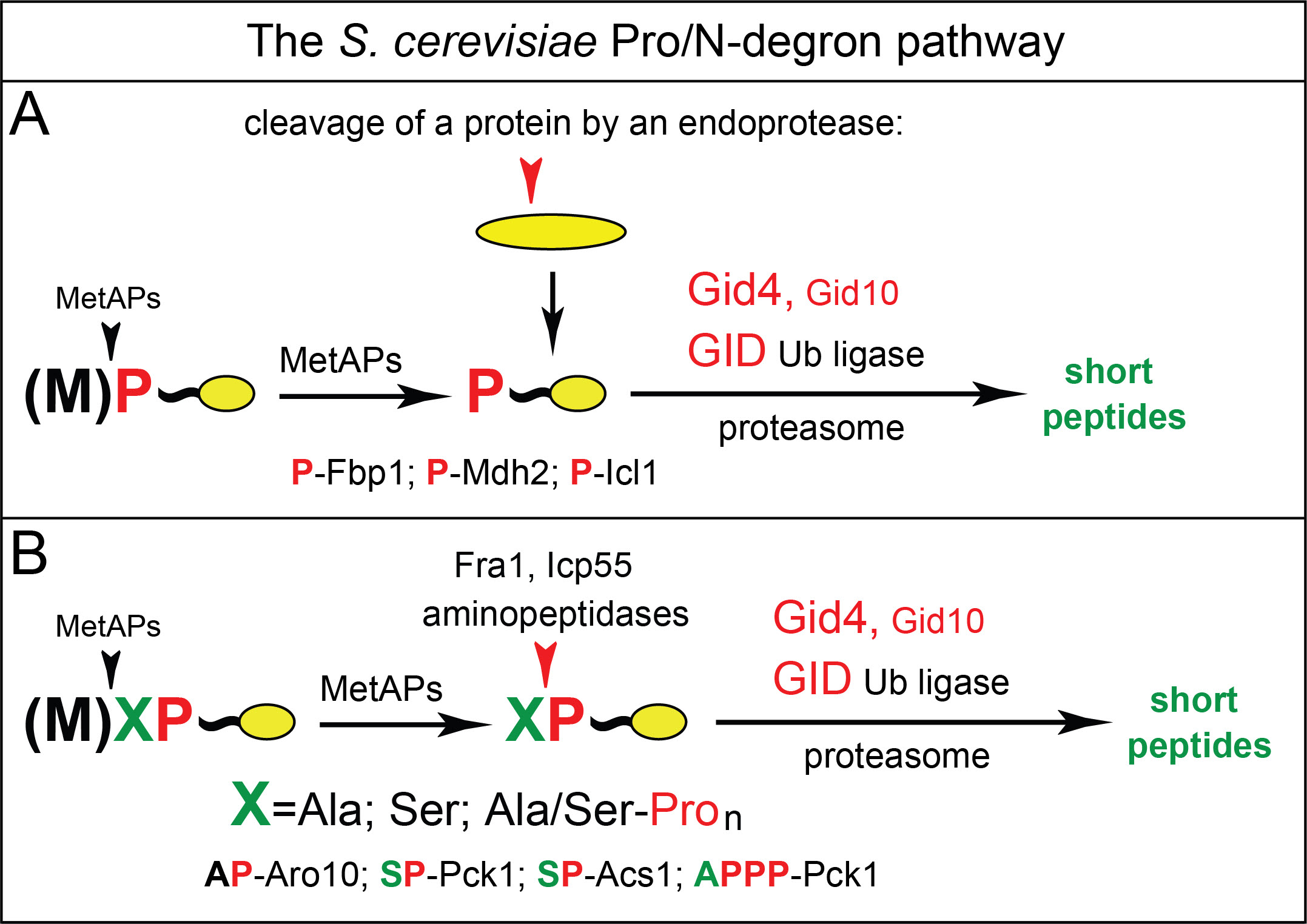
[그림1] 본 연구를 통해 확립된 Pro/N-degron 경로.
(A) 기존에 알려진 경로. (B) 본 연구로 확장된 경로.